Μάθημα : ΧΗΜΕΙΑ Α΄ ΛΥΚΕΙΟΥ
Κωδικός : EL1207112
-
Θεματικές Ενότητες
-
Δωρεάν βοήθημα
-
Άτομα
-
Διαλυτότητα
-
Περιοδικός Πίνακας
-
Μεταβολή ιδιοτήτων στον Περιοδικό Πίνακα
-
Χημικός Δεσμός
-
Αριθμός Οξείδωσης
-
Ονοματολογία
-
Ορισμός, συμβολισμός και ταξινόμηση οξειδίων
-
Χημικές Αντιδράσεις
-
Βασικές έννοιες για τους χημικούς υπολογισμούς
-
Καταστατική εξίσωση των αερίων
-
Διαλύματα
-
Αραίωση - Συμπύκνωση - Ανάμιξη διαλυμάτων
-
Επαναληπτικά Θέματα
-
Τράπεζα Θεμάτων 2020 - 21
-
Δωρεάν βοήθημα
Καταστατική εξίσωση των αερίων
Τι είναι ένα ιδανικό αέριο; Ποια είναι η συμπεριφορά του;
Η συμπεριφορά των αερίων είναι περισσότερο απλή και ομοιόμορφη από τη συμπεριφορά των υγρών και των στερεών. Σε αντίθεση με τις υγρές και τις στερεές ουσίες, ορισμένες βασικές ιδιότητες των αερίων είναι ανεξάρτητες της χημικής τους φύσης.
Αυτές οι βασικές ιδιότητες μπορούν να περιγραφούν με νόμους, όπως είναι: Ο του νόμος Boyle, Ο νόμος του Charles και ο νόμος του Gay-Lussac.
Με συνδυασμό των παραπάνω νόμων, καταλήγουμε σε μια εξίσωση που ονομάζεται καταστατική εξίσωση των ιδανικών αερίων.
Τα αέρια που υπακούουν στην καταστατική εξίσωση, για οποιαδήποτε τιμή πίεσης και θερμοκρασίας, ονομάζονται ιδανικά αέρια. Τα περισσότερα αέρια, κάτω από συνθήκες χαμηλής πίεσης και υψηλής θερμοκρασίας, προσεγγίζουν την ιδανική συμπεριφορά και συνεπώς υπακούουν στους νόμους των αερίων.
Όταν όμως βρίσκονται μακριά από τις συνθήκες που υγροποιούνται, δηλαδή σε χαμηλές θερμοκρασίες και υψηλές πιέσεις παρατηρούνται αποκλίσεις, τόσο από την καταστατική εξίσωση όσο και από τους νόμους των αερίων.
Και τα περισσότερα μίγματα αερίων, κάτω από ορισμένες συνθήκες πίεσης και θερμοκρασίας συμπεριφέρονται σαν ιδανικά αέρια.
Για ποσότητα αερίου που βρίσκεται σε δοχείο όγκου V υπό πίεση P και σε (απόλυτη) θερμοκρασία Τ, ισχύει η σχέση:
P·V = n·R·T
Στην εξίσωση αυτή η πίεση μετράται σε atm, ό όγκος σε L και η απόλυτη θερμοκρασία (Τ) σε K (Kelvin) και είναι η καταστατική εξίσωση των ιδανικών αερίων.
R είναι μια σταθερά που ονομάζεται παγκόσμια σταθερά των ιδανικών αερίων και παίρνει την τιμή:
R = 0,082 L · atm / mol · K
H απόλυτη θερμοκρασία προκύπτει από τη σχέση: T = ( θ + 273) K (όπου θ η θερμοκρασία σε βαθμούς Κελσίου).
n = συνολικός αριθμός των mol των αερίων.
Σε περίπτωση μίγματος αερίων n = n1 + n2 +n3 + . . .
η τιμή της R δεν χρειάζεται να απομνημονευθεί.
Παράδειγμα
Σε δοχείο όγκου 15 L και θερμοκρασίας 27 °C, εισάγονται 4 mol αερίου Α. Να υπολογιστεί η πίεση που ασκεί το αέριο στο δοχείο.
Αφού γνωρίζουμε τη θερμοκρασία, τον όγκο και την ποσότητα σε mol του αερίου μπορούμε να βρούμε πόση πίεση ασκεί, από την καταστατική εξίσωση.
Πρώτα υπολογίζουμε την απόλυτη θερμοκρασία:
Τ = θ + 273 = (27+273) Κ = 300 Κ
και στη συνέχεια εφαρμόζουμε την καταστατική εξίσωση
P·V = n·R·T ⇒ P · 15 = 4 · 0,082 · 300 ⇒ P = 6,56 atm
On Line Ερωτήσεις
8 Ερωτήσεις Σωστού - Λάθους στις βασικές έννοιες
Υπολογισμός της Πυκνότητας ενός Αερίου
Με τη χρήση της καταστατικής εξίσωσης των αερίων πορούμε να υπολογίσουμε την πυκνότητα ενός αερίου:
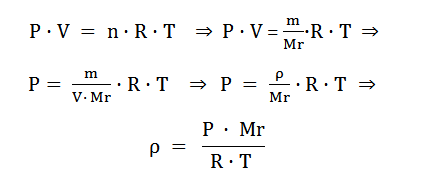
Υπολογισμός Mr ενός αερίου
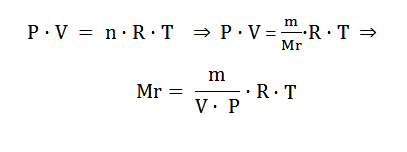
On Line Ερωτήσεις
Δίνεται η παγκόσμια σταθερά των αερίων R = 0,082 L·atm·K-1·mol-1
Επαναληπτικό Υλικό από την ΕΕΧ. Επιμέλεια: 1-7 Τόλκου Αθανασία, 8-11 Φιλένια Σιδέρη
R = 0.082 L·atm·mol-1·K-1. Πίνακας με Σχετικές Ατομικές μάζες εδώ
11 Ερωτήσεις από θέματα Πανελλήνιων Διαγωνισμών Χημείας.
Για δυνατούς Λύτες
On Line Quiz
Οι Ερωτήσεις Σ-Λ της Τράπεζας Θεμάτων (2014)
4 Ερωτήσεις με αιτιολόγηση
On Line Ερωτήσεις σε Hot Potatoes
16 Ερωτήσεις Πολλαπλής Επιλογής
Η θεωρία της ενότητας σε αρχείο για εκτύπωση