Μάθημα : ΧΗΜΕΙΑ Α΄ ΛΥΚΕΙΟΥ
Κωδικός : EL1207112
-
Θεματικές Ενότητες
-
Δωρεάν βοήθημα
-
Άτομα
-
Διαλυτότητα
-
Περιοδικός Πίνακας
-
Μεταβολή ιδιοτήτων στον Περιοδικό Πίνακα
-
Χημικός Δεσμός
-
Αριθμός Οξείδωσης
-
Ονοματολογία
-
Ορισμός, συμβολισμός και ταξινόμηση οξειδίων
-
Χημικές Αντιδράσεις
-
Βασικές έννοιες για τους χημικούς υπολογισμούς
-
Καταστατική εξίσωση των αερίων
-
Διαλύματα
-
Αραίωση - Συμπύκνωση - Ανάμιξη διαλυμάτων
-
Επαναληπτικά Θέματα
-
Τράπεζα Θεμάτων 2020 - 21
-
Δωρεάν βοήθημα
Μεταβολή ιδιοτήτων στον Περιοδικό Πίνακα
Που βρίσκονται τα Μέταλλα; Που τα Αμέταλλα;
Ατομική ακτίνα (το μέγεθος του ατόμου)

Η ατομική ακτίνα ενός ατόμου καθορίζεται από τη δύναμη με την οποία τα ηλεκτρόνια της εξωτερικής στιβάδας συγκρατούνται από τον πυρήνα.
Όσο μεγαλύτερη είναι αυτή η δύναμη, τόσο πιο μικρό είναι το άτομο με αποτέλεσμα
όσο πιο μικρό είναι ένα άτομο, τόσο πιο δύσκολα χάνει ηλεκτρόνια.
Αντίθετα, όσο πιο μεγάλο είναι ένα άτομο, τόσο πιο εύκολα χάνει ηλεκτρόνια.
Κατά μήκος μιας περιόδου η ατομική ακτίνα ελαττώνεται από τα αριστερά προς τα δεξιά.
Σε μία ομάδα η ατομική ακτίνα αυξάνεται από πάνω προς τα κάτω.
Γιατί συμβαίνει αυτό;
Οσο πηγαίνουμε προς τα δεξιά αυξάνει ο ατομικός αριθμός, κατά συνέπεια αυξάνει το θετικό φορτίο του πυρήνα, με αποτέλεσμα να μειώνεται η ακτίνα, λόγω μεγαλύτερης έλξης και των ηλεκτρονίων της εξωτερικής στιβάδας από τον πυρήνα. Μιλώντας για στοιχεία της ίδιας περιόδου που έχουν την ίδια εξωτερική στιβάδα συμπεραίνουμε ότι:
Κατά μήκος μιας περιόδου η ατομική ακτίνα ελαττώνεται από τα αριστερά προς τα δεξιά.
Όσο πηγαίνουμε προς τα κάτω προστίθενται στιβάδες στο άτομο, οπότε μεγαλώνει η απόσταση ηλεκτρονίων σθένους (ηλεκτρόνια της εξωτερικής στιβάδας) από τον πυρήνα, η έλξη μειώνεται, συνεπώς η ατομική ακτίνα αυξάνεται άρα
Σε μία ομάδα η ατομική ακτίνα αυξάνεται από πάνω προς τα κάτω.
Μεταβολή της Ατομικής Ακτίνας (1) *
Βάλε τα στοιχεία στην θέση τους. Δες πως μεταβάλεται η ατομική ακτίνα. Πάτα τον διακόπτη για να μετραπούν σε ιόντα. Τι συμβαίνει με το μέγεθος των ιόντων;
(1) Από το http://www.chem.iastate.edu/
Θέση των Μετάλλων και των Αμετάλλων στον Περιοδικό πίνακα.
Τα Μέταλλα έχουν την τάση να αποβάλλουν ηλεκτρόνια και να γίνονται θετικά ιόντα (κατιόντα) - (ηλεκτροθετικά).
Όταν ένα στοιχείο αποβάλλει πιο εύκολα ηλεκτρόνια από κάποιο άλλο τότε θεωρείται ότι έχει περισσότερο μεταλλικό χαρακτήρα.
Η θέση τους είναι στο αριστερό τμήμα του Περιοδικού πίνακα . (Ομάδες 1-3, στον πίνακα που περιλαμβάνει τα 20 πρώτα στοιχεία).
Τα Αμέταλλα έχουν την τάση να προσλαμβάνουν ηλεκτρόνια και να γίνονται αρνητικά ιόντα (ανιόντα) - (ηλεκτραρνητικά).
Η θέση τους είναι στο δεξί τμήμα του Περιοδικού πίνακα. (Ομάδες 4-8)
Δηλαδή, με αλλά λόγια κατά μήκος μιας περιόδου έχουμε αύξηση του μεταλλικού χαρακτήρα από αριστερά προς τα δεξιά.

Αφού ο μεταλλικός χαρακτήρας αυξάνεται από αριστερά προς τα δεξιά, είναι ασφαλές να πούμε ότι
κατά μήκος μιας περιόδου έχουμε αύξηση του αμεταλλικού χαρακτήρα από δεξιά προς τα αριστερά.
Κατά μήκος μιας περιόδου ο μεταλλικός χαρακτήρας αυξάνεται από δεξιά προς τα αριστερά, επειδή με την ίδια φορά μεγαλώνει η ατομική ακτίνα και μικραίνει το φορτίο στον πυρήνα. Αυτό έχει σαν αποτέλεσμα τα ηλεκτρόνια της τελευταίας στιβάδας να έλκονται με μικρότερη δύναμη από τον πυρήνα και να αποβάλλονται ευκολότερα.
Κατά μήκος μιας ομάδας ο μεταλλικός χαρακτήρας αυξάνεται από πάνω προς τα κάτω και παρά την αύξηση του φορτίου του πυρήνα, η προσθήκη μιας στιβάδας έχει σαν αποτέλεσμα τα ηλεκτρόνια της τελευταίας στιβάδας να έλκονται με μικρότερη δύναμη από τον πυρήνα και να αποβάλλονται ευκολότερα.
Γενικά η θέση των μετάλλων και αμετάλλων αποδίδεται από τα επόμενα.
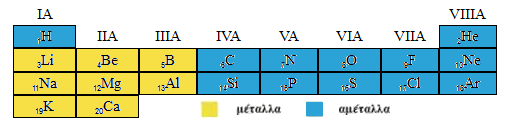
Η εικόνα για την θέση των μετάλλων και αμετάλλων στον πλήρη Περιοδικό Πίνακα είναι η παρακάτω.(1)

(1) Από το σχολικό βιβλίο της Γ Γυμνασίου.
On Line Ερωτήσεις
15 Ερωτήσεις Πολλαπλής Επιλογής
On Line Quiz
Οι Ερωτήσεις Σ-Λ της Τράπεζας Θεμάτων (2014)
5 Ερωτήσεις με αιτιολόγηση
Η θεωρία της ενότητας σε αρχείο για εκτύπωση
