Μάθημα : ΧΗΜΕΙΑ Α΄ ΛΥΚΕΙΟΥ
Κωδικός : EL1207112
-
Θεματικές Ενότητες
-
Δωρεάν βοήθημα
-
Άτομα
-
Διαλυτότητα
-
Περιοδικός Πίνακας
-
Μεταβολή ιδιοτήτων στον Περιοδικό Πίνακα
-
Χημικός Δεσμός
-
Αριθμός Οξείδωσης
-
Ονοματολογία
-
Ορισμός, συμβολισμός και ταξινόμηση οξειδίων
-
Χημικές Αντιδράσεις
-
Βασικές έννοιες για τους χημικούς υπολογισμούς
-
Καταστατική εξίσωση των αερίων
-
Διαλύματα
-
Αραίωση - Συμπύκνωση - Ανάμιξη διαλυμάτων
-
Επαναληπτικά Θέματα
-
Τράπεζα Θεμάτων 2020 - 21
-
Δωρεάν βοήθημα
Χημικός Δεσμός
Τι είναι ο Χημικός δεσμός; Πότε και γιατί δημιουργείται;
Ο χημικός δεσμός, με απλά λόγια, είναι η «κόλλα» που δένει τα άτομα (ή άλλες δομικές μονάδες της ύλης, π.χ. ιόντα) προς σχηματισμό ενώσεων.
Tα στοιχεία ενώνονται μεταξύ τους και σχηματίζουν χημικές ενώσεις και η δύναμη που συγκρατεί τα άτομα (ή άλλες δομικές μονάδες της ύλης, π.χ. ιόντα) ενωμένα μεταξύ τους λέγεται χημικός δεσμός.
Η δημιουργία του χημικού δεσμού οδηγείτο σύστημα σε χαμηλότερη ενέργεια, το κάνει δηλαδή ενεργειακά σταθερότερο.
Πως όμως σχηματίζεται ο χημικός δεσμός;
Τα άτομα έχουν την τάση να σχηματίζουν χημικούς δεσμούς, έτσι ώστε να αποκτήσουν ηλεκτρονική δομή ίδια με αυτήν των ευγενών αερίων, δηλαδή 8 ηλεκτρόνια στην εξωτερική στιβάδα (ή 2 ηλεκτρόνια αν η στιβάδα αυτή είναι η K).
Τα άτομα μπορούν να αποκτήσουν σταθερή ηλεκτρονική δομή με τρεις διαφορετικούς μηχανισμούς:
α. αποβάλλοντας ηλεκτρόνια
β. προσλαμβάνοντας ηλεκτρόνια
γ. συνεισφέροντας ηλεκτρόνια
Τα ηλεκτρόνια που εμπλέκονται στο σχηματισμό δεσμών είναι αυτά της εξωτερικής στοιβάδας κάθε ατόμου (στιβάδα σθένους).
Με βάση τη συμπεριφορά αυτή τα στοιχεία υποδιαιρούνται σε δύο βασικές ομάδες:
Τα ηλεκτροθετικά στοιχεία, τα άτομα των οποίων αποβάλλουν σχετικά εύκολα ένα ή και περισσότερα ηλεκτρόνια δηλαδή τα Μέταλλα.
Τα ηλεκτραρνητικά στοιχεία, τα άτομα των οποίων προσλαμβάνουν σχετικά εύκολα ένα ή περισσότερα ηλεκτρόνια δηλαδή τα Αμέταλλα.
Η χημική συμπεριφορά των στοιχείων καθορίζεται, εκτός από τα ηλεκτρόνια σθένους του και από το ατομική ακτίνα δηλαδή το μέγεθος του ατόμου. Όπως έχει ήδη αναφερθεί το μέγεθος ενός ατόμου καθορίζει τη δύναμη με την οποία τα ηλεκτρόνια της εξωτερικής στιβάδας συγκρατούνται από τον πυρήνα.
δηλαδή, όσο πιο μικρό είναι ένα άτομο, τόσο πιο δύσκολα χάνει ηλεκτρόνια, ή τόσο πιο εύκολα παίρνει ηλεκτρόνια.
Αντίθετα, όσο πιο μεγάλο είναι ένα άτομο, τόσο πιο εύκολα χάνει ηλεκτρόνια, ή τόσο πιο δύσκολα παίρνει.
Είδη χημικών δεσμών
Πως δημιουργείται ο Χημικός Δεσμός;* (1)
Πάτα πάνω στην εικόνα
Συνοψίζοντας για τον ιοντικό δεσμό έχουμε:
Ο ιοντικός ή ετεροπολικός δεσμός, όπως υποδηλώνει το όνομα του, σχηματίζεται μεταξύ ενός μετάλλου και ενός αμετάλλου. Ο δεσμός αυτός απορρέει από την έλξη αντίθετα φορτισμένων ιόντων, κατιόντων (που είναι θετικά φορτισμένα) και ανιόντων (που είναι αρνητικά φορτισμένα).
Τα ιόντα αυτά σχηματίζονται με μεταφορά ηλεκτρονίων, αποβολή από το μέταλλο πρόσληψη από το αμέταλλο.
Για τον ομοιοπολικό δεσμό έχουμε:
Mε ομοιοπολικό δεσμό, όπως υποδηλώνει και το όνομά του, μπορούν να συνδεθούν αμέταλλα. Όταν δύο αμέταλλα κατέχουν από κοινού ένα ή περισσότερα ζευγάρια ηλεκτρονίων, λέμε ότι συνδέονται με ομοιοπολικό δεσμό.
(1) Από το http://www.teachersdomain.org
Παραδείγματα Ιοντικών Δεσμών
Δημιουργία του NaCl

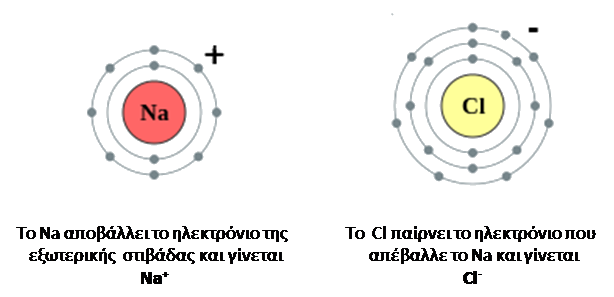
Με αυτό τον τρόπο σχηματίζεται το NaCl που μπορεί να παρασταθεί με τον επόμενο ηλεκτρονιακό τύπο.

Δημιουργία του CaF2


Με αυτό τον τρόπο σχηματίζεται το CaF2 που μπορεί να παρασταθεί με τον επόμενο ηλεκτρονιακό τύπο

Δημιουργία του K2S
Το K ανήκει στην 1η κύρια ομάδα και το S στην 6η κύρια ομάδα. Σκεπτόμενοι ανάλογα με το προηγούμενο παράδειγμα καταλήγουμε στο συμπερασμα ότι ο ηλεκτρονιακός τύπος του K2S είναι:
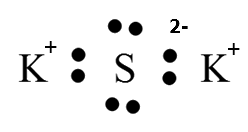
Παραδείγματα Ομοιοπολικών δεσμών.
Δεσμοί πολικοί - μη πολικοί. Απλοί - διπλοί κλπ
Πάτα πάνω στην εικόνα
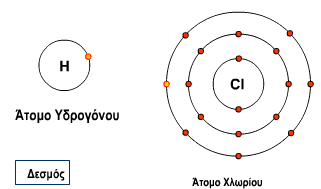
Δες τον Σχηματισμό του δεσμού στο HCl*(1)
Στο animation βλέπουμε τον σχηματισμό του ομοιοπολικού δεσμού στο HCl. Παρατηρούμε ότι:
Το Υδρογόνο έχει ένα ηλεκτρόνιο στην εξωτερική του στιβάδα και το Χλώριο επτά. Είναι και τα δύο αμέταλλα. Θα σχηματίσουν ομοιοπολικό δεσμό σχηματίζοντας κοινό ζευγάρι ηλεκτρονίων συνεισφέροντας από ένα ηλεκτρόνιο το κάθε στοιχείο.

το HCl μπορεί να παρασταθεί με τον παραπάνω ηλεκτρονιακό τύπο
(1) Από το http://www.bbc.co.uk/schools/gcsebitesize/
Τα (*) απαιτούν ενεργοποιημένο Adobe Flash Player
Δημιουργία δεσμού στο Cl2

 |
το Cl2 μπορεί να παρασταθεί με τον επόμενο ηλεκτρονιακό τύπο

Ομοιοπολικός πολικός - Ομοιοπολικός μη πολικός
Διαφέρει σε κάτι ο ομοιοπολικός δεσμός στο Cl2 από αυτόν στο HCl;
Αν τα άτομα που σχηματίζουν τον ομοιοπολικό δεσμό είναι όμοια μεταξύ τους, όπως π.χ. στο μόριο του Cl2, τότε το κοινό ζεύγος ηλεκτρονίων του ομοιοπολικού δεσμού έλκεται εξ ίσου από τους πυρήνες των δύο ατόμων, οπότε έχουμε ομοιόμορφη κατανομή του κοινού ζεύγους των ηλεκτρονίων μεταξύ των δύο ατόμων. Στην περίπτωση αυτή έχουμε ένα μη πολικό (μη πολωμένο) ομοιοπολικό δεσμό.
Αν τα άτομα που σχηματίζουν τον ομοιοπολικό δεσμό είναι διαφορετικά μεταξύ τους, όπως π.χ. στο μόριο του ΗCl, τότε το κοινό ζεύγος ηλεκτρονίων του ομοιοπολικού δεσμού δεν έλκεται εξ ίσου από τους πυρήνες των δύο ατόμων, οπότε δεν έχουμε ομοιόμορφη κατανομή του κοινού ζεύγους των ηλεκτρονίων μεταξύ των δύο ατόμων. Στην περίπτωση αυτή έχουμε ένα πολικό (πολωμένο) ομοιοπολικό δεσμό.
Επί πλέον παραδείγματα ομοιοπολικών δεσμών
Οι δεσμοί στο μόριο του νερού.
H2O

Στο μόριο του νερού υπάρχουν δύο απλοί ομοιοπολικοί πολικοί δεσμοί.
Οι δεσμοί στο μόριο του Οξυγόνου.
O2

Στο μόριο του Οξυγόνου υπάρχει ένας διπλός ομοιοπολικός μη πολικός δεσμός.
Οι δεσμοί στο μόριο του Διοξειδίου του Άνθρακα.
CO2

Στο μόριο του διοξειδίου του άνθρακα υπάρχουν δύο διπλοί ομοιοπολικοί πολικοί δεσμοί
Τι δεσμός θα σχηματισθεί; Μπορείς να τον προβλέψεις; *(1)
Επέλεξε ένα μέταλλο ή αμέταλλο. Ένωσέτο με άλλο στοιχείο. Τι δεσμό θα κάνουν;
(1) Από το http://www.iastate.edu/
Τα (*) απαιτούν ενεργοποιημένο Adobe Flash Player
Ηλεκτρονιακοί και συντακτικοί τύποι
Οι παραστάσεις, που δείχνουν την κατανομή των ηλεκτρονίων σθένους στο μόριο, καθώς και το σχηματισμό των ομοιοπολικών δεσμών, ονομάζονται ηλεκτρονιακοί τύποι π.χ.
 |
 |
 |
Οι παραστάσεις, που δείχνουν τους ομοιοπολικούς δεσμούς στο μόριο με μία γραμμή, ονομάζονται συντακτικοί τύποι π.χ
 |
 |
 |
Λογικό Διάγραμμα
για εύκολη εύρεση του τύπου του Χημικού Δεσμού
Ηλεκτραρνητικότητα στοιχείου
Ηλεκτραρνητικότητα στοιχείου ονομάζεται η τάση του ατόμου στοιχείου να έλκει ηλεκτρόνια, όταν αυτό συμμετέχει στο σχηματισμό πολυατομικών συγκροτημάτων.
Όσο πιο ηλεκτραρνητικό είναι ένα στοιχείο τόσο πιο πολύ αμέταλλο είναι. Η ηλεκτραρνητικότητα στον περιοδικό πίνακα αυξάνεται από δεξιά προς τα αριστερά και από κάτω προς τα επάνω, όπως ακριβώς και ο αμεταλλικός χαρακτήρας.

Ηλεκτροθετικότητα στοιχείου
ονομάζεται η τάση του ατόμου στοιχείου να αποβάλλει ηλεκτρόνια.
Όσο πιο ηλεκτροθετικό είναι ένα στοιχείο τόσο πιο πολύ μέταλλο είναι. Η ηλεκτροθετικότητα στον περιοδικό πίνακα αυξάνεται από αριστερά προς τα δεξιά και από επάνω προς τα κάτω, όπως ακριβώς και ο μεταλλικός χαρακτήρας.

Χαρακτηριστικά ιοντικών και ομοιοπολικών ενώσεων
Χαρακτηριστικά ιοντικών ενώσεων
|
1. Ιοντικές ενώσεις είναι κατά πλειονότητα τα οξείδια των μετάλλων, τα υδροξείδια των μετάλλων και τα άλατα.
|
|
|
|
Χαρακτηριστικά ομοιοπολικών ή μοριακών ενώσεων 1. Οι μοριακές ενώσεις διαφέρουν εντυπωσιακά από τις ιοντικές, είναι δηλαδή διακριτά συμπλέγματα ατόμων (μόρια) και όχι εκτενή συσσωματώματα (κρύσταλλοι). Επιπλέον, οι ελκτικές δυνάμεις μεταξύ των μορίων είναι ασθενείς σε σχέση με αυτές μεταξύ των ιόντων στο κρυσταλλικό πλέγμα. Γι' αυτό οι μοριακές ενώσεις σχηματίζουν μαλακά στερεά με χαμηλά σημεία τήξεως, ή υγρά με χαμηλά σημεία βρασμού, ή αέρια σώματα. Υπάρχουν βέβαια περιπτώσεις στις οποίες τα άτομα συνδέονται μεταξύ τους και σχηματίζουν μεγαλομόρια, όπως είναι το διαμάντι ή ο γραφίτης, τα οποία χαρακτηρίζονται από εξαιρετική σκληρότητα και πολύ υψηλά σημεία τήξεως.
|
|
|
On Line Ερωτήσεις
On Line Quiz
Δες τις γνώσεις σε ένα σύντομο Quiz
10 Ερωτήσεις Πολλαπλής Επιλογής
Οι Ερωτήσεις Σ-Λ της Τράπεζας Θεμάτων (2014)
11 Ερωτήσεις με αιτιολόγηση
Η θεωρία της ενότητας σε αρχείο για εκτύπωση