Μάθημα : ΧΗΜΕΙΑ Α΄ ΛΥΚΕΙΟΥ
Κωδικός : EL1207112
-
Θεματικές Ενότητες
-
Δωρεάν βοήθημα
-
Άτομα
-
Διαλυτότητα
-
Περιοδικός Πίνακας
-
Μεταβολή ιδιοτήτων στον Περιοδικό Πίνακα
-
Χημικός Δεσμός
-
Αριθμός Οξείδωσης
-
Ονοματολογία
-
Ορισμός, συμβολισμός και ταξινόμηση οξειδίων
-
Χημικές Αντιδράσεις
-
Βασικές έννοιες για τους χημικούς υπολογισμούς
-
Καταστατική εξίσωση των αερίων
-
Διαλύματα
-
Αραίωση - Συμπύκνωση - Ανάμιξη διαλυμάτων
-
Επαναληπτικά Θέματα
-
Τράπεζα Θεμάτων 2020 - 21
-
Δωρεάν βοήθημα
Διαλύματα
Εκφράσεις περιεκτικότητας -Προσομοιώσεις Εργαστηρίου
Διαλύματα. Βασικές έννοιες
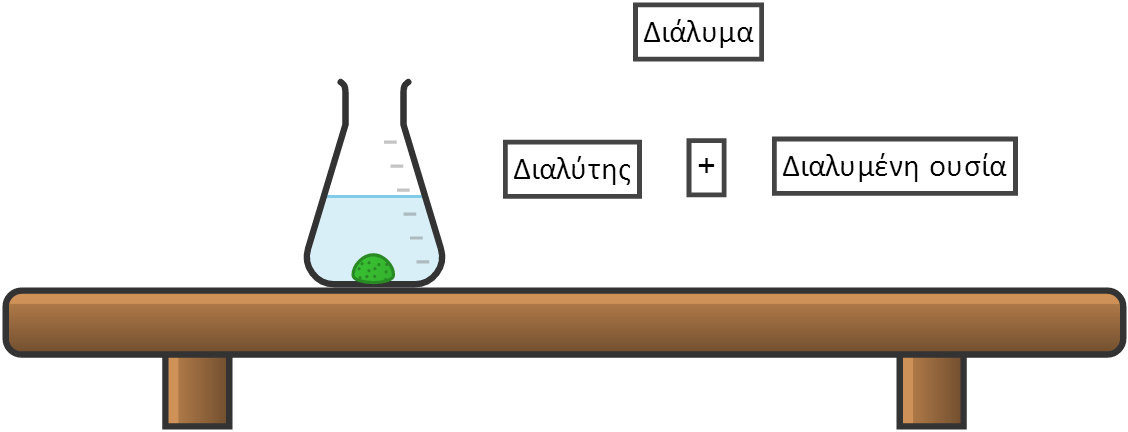
Τι είναι διάλυμα;
Διαλύματα ονομάζονται τα ομογενή μίγματα. Τα ομογενή μίγματα είναι ομοιόμορφα μίγματα, έχουν δηλαδή την ίδια σύσταση και τις ίδιες ιδιότητες σ' όλη την έκταση τους.
Κάθε διάλυμα αποτελείται από δυο ή περισσότερα συστατικά. Ένα από τα συστατικά αυτά ονομάζεται Διαλύτης, ενώ τα υπόλοιπα ονομάζονται διαλυμένες ουσίες.
Διαλύτη θεωρούμε το συστατικό που έχει τήν ίδια φυσική κατάσταση με το διάλυμα.
Στα υγρά διαλύματα ο διαλύτης βρίσκεται συνήθως σε μεγαλύτερη αναλογία. Το θαλασσινό νερό, αλλά και το νερό της βρύσης, το κρασί, ο ιδρώτας, τα δάκρυα είναι διαλύματα.
Σε όλα αυτά διαλύτης είναι το νερό. Τα διαλύματα στα οποία διαλύτης είναι το νερό ονομάζονται υδατικά.
Περιεκτικότητα ενός διαλύματος, είναι η ποσότητα της διαλυμένης ουσίας που περιέχεται σε ορισμένη ποσότητα διαλύματος.
Εκφράσεις Περιεκτικότητας Διαλυμάτων
Οι πιο συνηθισμένες εκφράσεις είναι:
- περιεκτικότητα στα εκατό κατά βάρος (% w/w).
- περιεκτικότητα στα εκατό βάρους κατ’ όγκον (% w/v).
- περιεκτικότητα στα εκατό όγκου σε όγκο (% v/v).
Με τον ορισμό του mol δημιουργήθηκε ένας καινούργιος τρόπος έκφρασης της περιεκτικότητας που χρησιμοποιεί το mol, και ονομάζεται συγκέντρωση.
Περιεκτικότητα στα εκατό κατά βάρος (% w/w)
H % w/w περιεκτικότητα εκφράζει τη μάζα (σε g) της διαλυμένης ουσίας σε 100 g διαλύματος.
Ένα διάλυμα NaCl 5% w/w περιέχει 5 g NaCl (διαλυμένη ουσίας) ανά 100 g διαλύματος (τα υπόλοιπα 100 – 5 = 95 g είναι ο διαλύτης). Κατ’ αναλογία τα 200 g του ίδιου διαλύματος περιέχουν 10 g NaCl
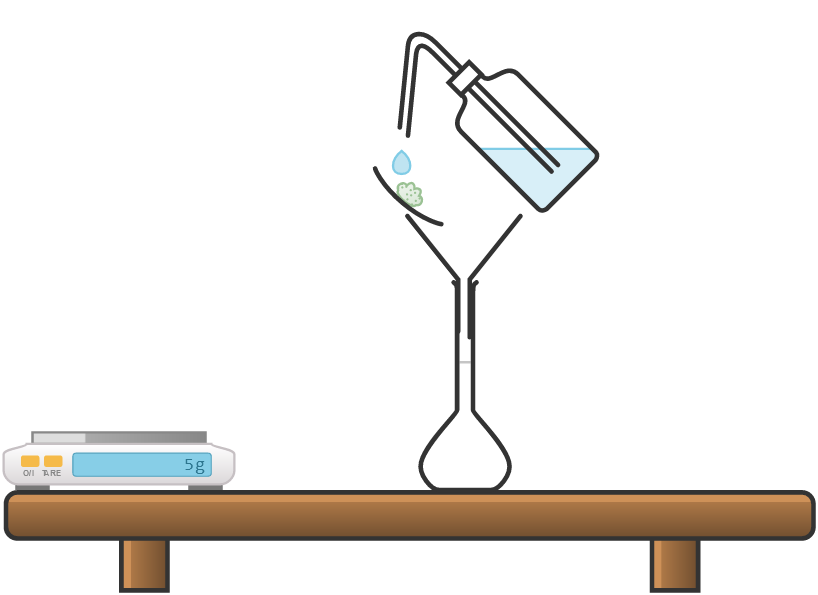
Πως παρασκευάζω στο εργαστήριο 100g διαλύματος NaCl περιεκτικότητας 5% w/w;

Σε ένα ποτήρι ζέσεως, ζυγίζω 5g NaCl
Στη συνέχεια προσθέτω νερό μέχρι η ζυγαριά να δείξει 100g

Χρησιμοποίησα 5g NaCl και 95g νερό και έφτιαξα ένα διάλυμα 100g περιεκτικότητας 5% w/w
Εικονικό εργαστήριο
Παρασκεύασε 100g διαλύματος ζαχαρόνερου
ΠΕΡΙΕΚΤΙΚΟΤΗΤΑ ΔΙΑΛΥΜΑΤΩΝ ΣΤΑ ΕΚΑΤΟ ΒΑΡΟΣ ΠΡΟΣ ΒΑΡΟΣ (% W/W) ΚΑΙ ΥΠΟΛΟΓΙΣΜΟΣ ΣΥΓΚΕΝΤΡΩΣΗΣ
Εικονικό εργαστήριο στο οποίο ο χρήστης έχει τη δυνατότητα να παρασκευάσει διαλύματα ζαχαρόνερου και αλατόνερου συγκεκριμένης περιεκτικότητας % w/w.
Στόχος του μαθησιακού αντικειμένου είναι η γνωριμία του χρήστη με τα όργανα του εργαστηρίου και η χρήση των οργάνων αυτών με τη σωστή σειρά για την εκτέλεση του πειράματος.
Μετά την ολοκλήρωση του πειράματος, υπάρχει η δυνατότητα επαλήθευσης, καθώς και εκ νέου προσπάθειας. Επίσης, παρέχεται η δυνατότητα υπολογισμού της συγκέντρωσης που αντιστοιχεί σε συγκεκριμένη περιεκτικότητα.
Το εικονικό εργαστήριο βρίσκεται στο Φωτόδεντρο
Περιεκτικότητα στα εκατό βάρους κατ' όγκον (% w/v)
Η % w/v περιεκτικότητα εκφράζει τη μάζα (σε g) της διαλυμένης ουσίας σε 100 mL του διαλύματος.
Έτσι, ένα διάλυμα NaCl 5% w/v περιέχει 5 g NaCl (διαλυμένη ουσίας) ανά 100 mL διαλύματος. Κατ’ αναλογία τα 200 mL του ίδιου διαλύματος περιέχουν 10 g NaCl
Πως παρασκευάζω στο εργαστήριο 100 mL διαλύματος NaCl περιεκτικότητας 5% w/v;

Με τη βοήθεια μιας υάλου ωρολογίου ζυγίζω 5g NaCl
Με τον υδροβολέα και τη χρήση ενός χωνιού μεταφέρω τη ποσότητα που ζύγισα σε μία ογκομετρική φιάλη των 100 mL.
Δεν γεμίζω κατευθείαν τη φιάλη!
Και όταν διαλυθεί

Γεμίζω μέχρι τη χαραγή.
Χρησιμοποίησα 5g NaCl και νερό τόσο όσο χρειάστηκε ώστε το διάλυμα να αποκτήσει όγκο 100mL.
Εικονικό εργαστήριο
Παρασκεύασε 100mL διαλύματος ζαχαρόνερου
ΠΕΡΙΕΚΤΙΚΟΤΗΤΑ ΔΙΑΛΥΜΑΤΩΝ ΣΤΑ ΕΚΑΤΟ ΒΑΡΟΣ ΠΡΟΣ ΟΓΚΟ (% W/V) ΚΑΙ ΥΠΟΛΟΓΙΣΜΟΣ ΣΥΓΚΕΝΤΡΩΣΗΣ
Εικονικό εργαστήριο στο οποίο ο χρήστης έχει τη δυνατότητα να παρασκευάσει διαλύματα ζαχαρόνερου, βρωμιούχου καλίου και αλατόνερου συγκεκριμένης περιεκτικότητας % w/v.
Στόχος του μαθησιακού αντικειμένου είναι η γνωριμία του χρήστη με τα όργανα του εργαστηρίου και η χρήση των οργάνων αυτών με τη σωστή σειρά για την εκτέλεση του πειράματος.
Για τη διευκόλυνση του χρήστη, παρέχεται η δυνατότητα υπολογισμού της συγκέντρωσης που αντιστοιχεί σε συγκεκριμένη περιεκτικότητα.
Το εικονικό εργαστήριο βρίσκεται στο Φωτόδεντρο
Περιεκτικότητα στα εκατό όγκου σε όγκο (% v/v)
Χρησιμοποιείται σε ειδικότερες περιπτώσεις:
Η % v/v περιεκτικότητα εκφράζει τον όγκο (σε mL) της διαλυμένης ουσίας σε 100 mL του διαλύματος.
α. Για να εκφράσει την περιεκτικότητα υγρού σε υγρό. Δηλαδή, η ένδειξη στη μπίρα 3% v/v ή 3° (αλκοολικοί βαθμοί) υποδηλώνει ότι περιέχονται 3 mL οινοπνεύματος στα 100 mL της μπίρας.
β. Για να εκφράσει την περιεκτικότητα ενός αερίου σε αέριο μίγμα. Δηλαδή η έκφραση ότι ο αέρας έχει περιεκτικότητα 20% ν/ν σε οξυγόνο, υποδηλώνει ότι περιέχονται 20 cm3 οξυγόνου στα 100 cm3 αέρα.
On Line Ερωτήσεις
Διαλύτης = συνήθως το ΝΕΡΟ
διαλυμένη ουσία = ότι διαλύεται στο νερό
Μάζα Διαλύματος = Μάζα διαλύτη + μάζα διαλυμένης ουσίας
Όγκος Διαλύματος = Όγκος Διαλύτη
10 Ερωτήσεις Συμπλήρωσης Κενού και 5 Πολλαπλής Επιλογής
On Line Quiz
17 Ερωτήσεις πολλαπλής επιλογής στην % περιεκτικότητα των διαλυμάτων
Συγκέντρωση ή μοριακότητα κατ' όγκο διαλύματος
Η μοριακότητα κατ' όγκο ή συγκέντρωση ή Molarity, εκφράζει τα mol διαλυμένης ουσίας που περιέχονται σε 1 L διαλύματος. Δηλαδή, έχουμε:
Όπου,
c = η συγκέντρωση του διαλύματος
n = ο αριθμός mol της διαλυμένης ουσίας και
V = ο όγκος του διαλύματος σε L.
Μονάδα της συγκέντρωσης είναι το mol L-1 ή Μ.
Έτσι, ένα διάλυμα Ζάχαρης 1Μ περιέχει 1 mol Ζάχαρης (διαλυμένη ουσία) ανά 1L (1000mL) διαλύματος.
Πως παρασκευάζω στο εργαστήριο 1L διαλύματος Ζάχαρης συγκέντρωσης 1M;
Το Mr της Ζάχαρης είναι 342. Ζυγίζω λοιπόν 342g Ζάχαρης.

Ζυγίζω 342g Ζάχαρης.

Στη συνέχεια προσθέτω 200 - 500 mL νερό και ανακατεύω με μία γυάλινη ράβδο για να διαλυθεί η Ζάχαρη.

Μέχρι τη χαραγή
Χρησιμοποίησα 1mol (342g) Ζάχαρη και νερό τόσο όσο χρειάστηκε ώστε το διάλυμα να αποκτήσει όγκο 1L.
Μετατροπές συγκεντρώσεων
Μετατροπή της %w/v περιεκτικότητας διαλύματος σε συγκέντρωση
Ξέρουμε δηλαδή τη μάζα της διαλυμένης ουσίας σε κάθε 100mL διαλύματος και θέλουμε να βρούμε την ποσότητα (σε mol) σε κάθε 1L διαλύματος.
Βρίσκω στην αρχή τη μάζα της διαλυμένης ουσίας σε 1000mL διαλύματος. Στη συνέχεια διαιρώ με το Mr της ουσίας και βρίσκω τα mol της. Επειδή αυτή η ποσότητα περιέχεται σε 1L διαλύματος είναι η συγκέντρωση.



